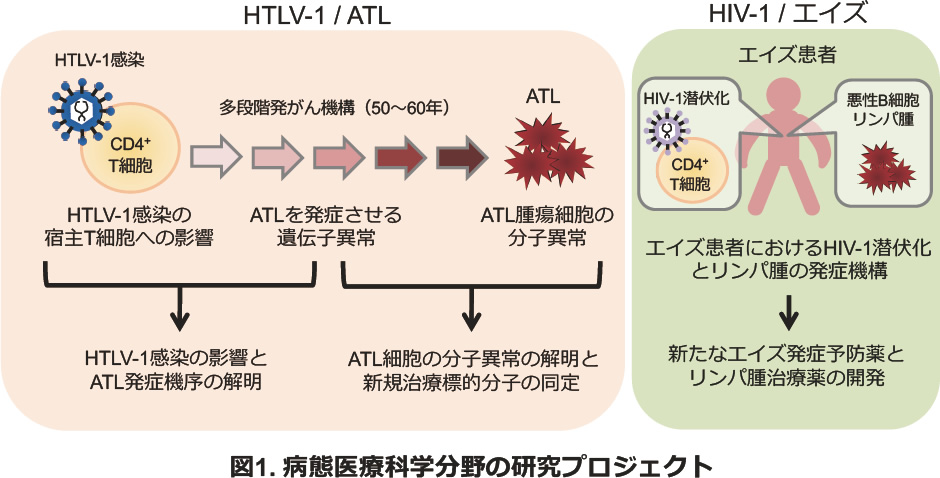
私たちの研究室では、ヒトレトロウイルスHuman T cell Leukemia Virus type I (HTLV-1)の感染により引き起こされる成人T細胞白血病・リンパ腫(Adult T cell leukemia, ATL)やHTLV-1関連脊髄症(HTLV-1 associated myelopathy, HAM)を対象に、HTLV-1感染の宿主T細胞への影響、多段階発がん機構、ATL腫瘍細胞やHAMの分子異常の3つの課題を柱に研究を行っています。特にHTLV-1感染とATL発症に伴うゲノム異常、エピゲノム異常、遺伝子発現異常を統合解析し、HTLV-1感染予防、ATL発症予防、そしてATLやHAMに対する新たな治療薬の開発に役立てることを目指しています。また、他の悪性リンパ腫や、HTLV-1と同じヒトレトロウイルスHIV-1によるエイズの分子病態についても研究を進めています(図1)。
また私たちの研究室はHTLV-1感染対策の政策研究の拠点の一つという性格も持っています。全国に100万人以上いるHTLV-1キャリアの現状の評価と対策の検討などを行うとともに、HTLV-1キャリアコホート研究(JSPFAD:Joint Study of Predisposing Factors on ATL Development: http://www.htlv1.org/)を中心的に運営しています。また厚生労働省の研究班の活動として、HTLV-1キャリアの実態調査と情報提供のためのウェブサイト「キャリねっと」(https://htlv1carrier.org/)の運営を行い、HTLV-1感染対策の政策研究を行っています。
研究紹介
私たちの研究室では、血液腫瘍学を専門とする内丸教授と、ウイルス腫瘍学を専門とする中野准教授が連携して研究を進めている。ATL(Adult T-cell Leukemia)は、ヒトレトロウイルスHTLV-1(Human T-cell leukemia Virus type 1)が主に母乳を介して伝播され、乳児のT細胞に感染することにより、60歳前後の高齢になってから発症する。ATLには未だ決定的な治療法が無く、最も予後不良な血液腫瘍疾患である。
【キーワード】HTLV-1、ATL、HTLV-1 Tax / Rex / HBZ、宿主病原体相互作用、ADC
(1)HTLV-1の臨床
HTLV-1はHTLV-1に感染した母親からおもに母乳を介して乳児に感染する母子感染と性交渉を介して感染する水平感染により伝搬する。全世界では1000万〜2000万人ほどの感染者が存在すると推定されているが、わが国はその中でも高浸淫地域の一つで、全国に100万人以上は感染者が存在すると考えられる。HTLV-1は感染してもほとんどが生涯にわたって無症状であり無症候性キャリアと呼ばれるが、約5%が成人T 細胞白血病リンパ腫(Adult T-cell Leukemia:ATL)という難治性の血液悪性腫瘍を発症し、その他わずかながらHTLV-1関連脊髄症(HTLV-1 Associated Myelopathy: HAM)、HTLV-1ぶどう膜炎(HTLV-1 Uveitis:HU)という炎症性疾患を数十年の潜伏期を経て発症する。ATLの化学療法による成績は大変厳しく、最近では新規分子標的薬の開発が進められるとともに、造血細胞移植により治癒を指向した治療が行われる。また、HTLV-1無症候性キャリアのうちの発症高危険群を同定して、早期に治療介入することも今後の課題である。内丸教授は医科学研究所附属病院でATL患者の診療にあたるとともに、HTLV-1無症候キャリアに対する専門外来を開設し、臨床データの解析を行っている。あわせて母子感染予防対策をはじめとするHTLV-1感染に対する厚生労働省の政策研究を行っている。
(2)HTLV-1ウイルス側からの研究
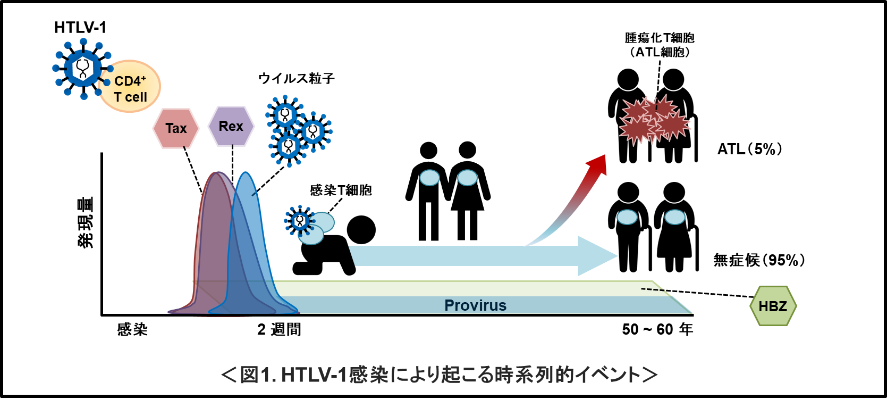
中野准教授は、HTLV-1の発がんウイルスとしての性質に興味を持っている。HTLV-1は、レトロウイルス科デルタレトロウイルス属に属する一本鎖のポジティブセンスRNAウイルスである。感染後、ウイルスゲノムRNAは逆転写と2本鎖DNAへの変換を経て、両末端にLTRを持つ約9kbのプロウイルスとして、宿主T細胞のヒトゲノムDNAに永続的に組み込まれる。プロウイルスには、ウイルス複製に必要な遺伝情報が全て含まれており、感染後宿主細胞の転写・翻訳機構を利用して10日〜14日間ほどウイルス複製が行われた後、速やかに潜伏感染状態に移行する(図1)。その後感染細胞は不死化し、キャリア体内で数十年に渡って生き延びると考えられている。感染初期において、プロウイルスからは、まずウイルスの主要な機能タンパク質であるTaxとRexを一緒にコードしたTax/Rex mRNAが5′-LTRから、HBZ (HTLV-1 basic region leucine-zipper) をコードしたHBZ mRNAが3′-LTRから転写される。Taxは5′-LTRを特異的かつ強力に活性化し、ウイルス粒子の構造タンパク質であるGag/Pro/Pol をコードする非スプライス型ウイルスmRNAと、Envをコードする不完全スプライス型ウイルス mRNAの転写を促進する。Rexはこれらの非/不完全スプライス型mRNAの3'-UTRにあるRxREモチーフに特異的に結合し、速やかに核外へ輸送し、宿主細胞の転写・翻訳・mRNA品質管理機構に介入しながらウイルスRNAをエスコートし、ウイルス粒子形成を促進する(Nakano et al., Microbes Infect. 15, 491-505. 2013; Viruses 14, 344. 2022; Viruses 14, 407. 2022)。HBZはTaxと拮抗的に作用してウイルス遺伝子の転写を負に制御する一方で、HTLV-1感染の効率を高め、感染T細胞の増殖を促進する。
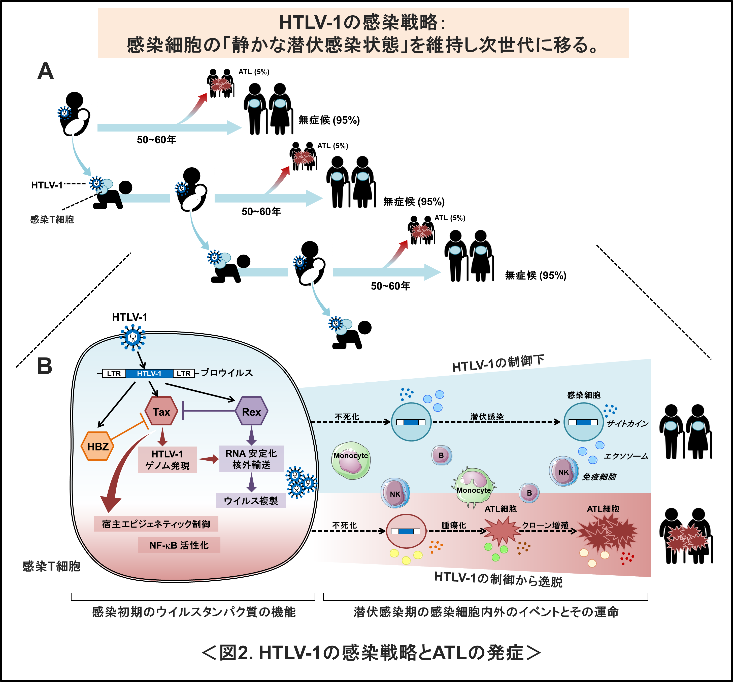
HTLV-1は時として重篤な血液腫瘍であるATLを引き起こすが、ATLを発症するのはHTLV-1感染者の約5%であり、95%の感染者は生涯にわたって無症候を維持する(図2A)。このことから中野准教授は、ヒトとの共進化の過程で、多くの場合病気を引き起こさない「静かな潜伏感染状態」を維持できる機構を進化させてきたのが、本来のHTLV-1の姿だと考えている。特に感染初期のウイルスタンパク質機能のパワーバランスと、その後の感染細胞の運命との関係を明らかにするため(図2B)、HTLV-1によって感染細胞内外に起こる事象を、実験的に検証するとともに、感染者やATL患者の血液細胞の性質を詳しく解析している。
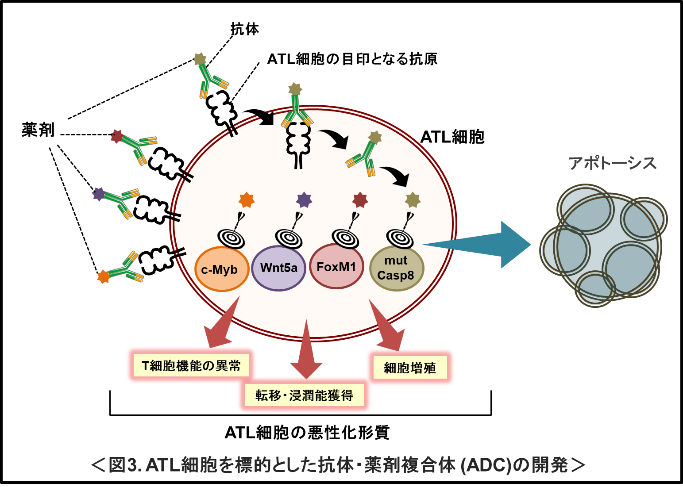
(3)ATL細胞に対する新規治療法の開発
中野准教授はまた、腫瘍細胞になってしまった感染T細胞、つまりATL細胞における標的因子の探索も行っている。これまでにATL細胞では正常なT細胞と比較して、c-Myb (Nakano et al., Clin Cancer Res. 22: 5915-5928. 2016)、Wnt5a (Nakano et al., Sci. Rep. 11: 4114. 2021)、FoxM1(未発表データ)などが過剰発現していること、本来はアポトーシスを誘導するCaspase8の変異体が過剰発現し、抗アポトーシス機能によりATL細胞の生存に寄与していることcells (Nakano et al., Mol. Cancer Res. 17: 2522-2536. 2019)を見出した。中野准教授は、これらの因子の阻害剤をATL細胞に効率良く届けることで、患者体内からATL細胞を除去できると考え、東大大学院工学系研究科、琉球大学、聖マリアンナ医科大学、国立感染症研究所との共同研究で、ATL細胞特異的に薬剤をデリバリーする抗体-薬剤複合体(ADC: antibody-drug conjugate)の開発を行っている(図3)。